Ruhr-Infektion:
Wächter-Proteine wecken Hoffnung auf neue Therapieansätze [15.05.17]
Uni Hohenheim schafft neue Erkenntnisse über Darmzellen: Protein erkennt von Bakterien verursachte Veränderungen der Zellstruktur. Ein Werkstattbericht
Unbekannte Eindringlinge an ihren Einbruchsspuren erkennen: Das können auch bestimmte Wächter-Proteine in Darmzellen, wie Forscher der Universität Hohenheim herausfanden. Dringt ein Erreger der Durchfallerkrankung Ruhr in die Darmzelle ein, bemerken sogenannte NOD1-Proteine den dadurch entstandenen Schaden an der Zellstruktur und schlagen Alarm. Das Forscherteam verfolgt nun den genauen Ablauf dieses Prozesses. Die Erkenntnisse könnten helfen lebensbedrohliche Infektionserkrankungen wie die Ruhr auch dann zu bekämpfen, wenn sich die Erreger durch Mutationen vor dem Immunsystem tarnen. Die Deutsche Forschungsgemeinschaft fördert das Projekt mit 430.000 Euro. Damit zählt es zu den Schwergewichten der Forschung an der Universität Hohenheim.
Bemerkt ein Nachtwächter ein zerbrochenes Fenster oder eine aufgehebelte Haustür, ruft er sofort die Polizei – auch wenn er den Einbrecher selbst gar nicht gesehen hat. Die Spuren des Einbruchs reichen aus, um Alarmbereitschaft auszulösen.
Forscher um den Immunologen Prof. Dr. Thomas Kufer an der Universität Hohenheim fanden nun heraus: Darmzellen reagieren auf Eindringlinge nach dem gleichen Prinzip. Denn in der menschlichen Darmzelle gibt es Wächter-Proteine, die „Einbruchspuren“ von Krankheitserregern erkennen und Alarm schlagen.
Wissenschaftlich gesehen handelt es sich bei den Wächtern um Rezeptoren in der Zelle, die sogenannten NOD1-Proteine. Bereits bekannt war, dass sie eindringende Bakterien an ihrer Oberflächenstruktur erkennen können. Forscher der Universität Hohenheim entdeckten nun eine zweite Fähigkeit der Wächter-Proteine: Sie bemerken die Veränderungen, die zum Beispiel Ruhr-Erreger in der Zelle auslösen.
Verräterisches Ungleichgewicht im Zellgewebe
Der Grund: wenn Ruhr-Erreger in Darmzellen eindringen, produzieren sie eigene Proteine, um sich in der Zelle einzurichten. Dadurch verändern sie das sogenannte Zytoskelett der Zelle: ein Geflecht aus fadenähnlichen Proteinen, den Aktinfilamenten, das der Zelle ihre Form gibt.
„Dadurch entsteht ein Ungleichgewicht im Zellgewebe und diese Veränderungen der Aktinfilamente können die NOD1-Proteine bemerken“, erklärt Immunologie Prof. Dr. Kufer. „Unsere Körperzellen haben also mehrere Möglichkeiten, Eindringlinge zu erkennen.“
Veränderungen der Zellstruktur als Beweismittel
Damit unterscheiden sich das NOD1-Protein von anderen Proteinen, die ebenfalls in der Lage sind, Bakterien zu erkennen und eine Abwehrreaktion auszulösen. Diese bekannte Gruppe wird auch als „Mustererkennungsrezeptoren“ bezeichnet, denn sie identifizieren eindringende Erreger normalerweise allein anhand ihrer körperfremden Oberflächenstrukturen.
Durch Veränderung ihrer Oberflächenstrukturen können die Bakterien jedoch der Erkennung durch Mustererkennungsrezeptoren entgehen, so Prof. Dr. Kufer.
Die NOD1-Proteine könnten dann für eine zweite Absicherung sorgen. „Auch wenn sich die Bakterien mit einer neuen Oberfläche tarnen - ihre Spuren an der Aktinstruktur bleiben gleich; die NOD1-Proteine können sie aufspüren und eine Abwehrreaktion auslösen.“
Grundlagenforschung, die Leben retten soll
Mit High-Tech-Methoden erforscht Prof. Dr. Kufer mit seinen Mitarbeiterinnen Dr. Kornelia Ellwanger und Christine Arnold nun, wie genau dieser Erkennungsmechanismus abläuft und auf welchem Weg das NOD1-Protein daraufhin eine Immunreaktion auslöst.
„Das ist Grundlagenforschung“, betont Prof. Dr. Kufer, „doch unsere Ergebnisse könnten in den Kampf gegen eine Krankheit einfließen, die jedes Jahr vor allem in Entwicklungsländern Millionen von Todesopfern fordert.“
Zudem könnten Wissenschaftler mit den Ergebnissen an Methoden arbeiten, um Proteine gezielt zu aktivieren oder zu unterdrücken.
Wächter-Proteine vor der Kamera
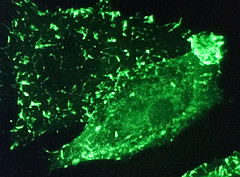
Aktuell erforschen Prof. Dr. Kufer und sein Team Details zur Arbeit der Wächterproteine mit der Kamera. Dazu verwenden sie das sogenannte Live Cell Imaging, bei dem lebende Zellen unter dem Mikroskop gefilmt werden.
Dazu haben sie menschliche Zellen so manipuliert, dass Aktinfilamente und NOD1-Proteine mit grün oder rot fluoreszierenden Markerproteinen verbunden werden, um erkennbar zu sein.
Dank der mikroskopischen Filmaufnahmen können die Wissenschaftler nun im Zeitraffer zusehen, wie sich die NOD1-Proteine durch die Zelle bewegen – und wie sich diese Bewegungen ändern, sobald sie die Zellen mit Ruhr-Erregern infizieren.
Erste Erkenntnisse zeigen eine enge Verbindung zwischen NOD1 und dem Zellstruktur-Protein Aktin. „Auf den Kamera-Aufnahmen können wir bereits sehen: NOD1 ist vor allem an der Zellmembran angesiedelt. Das heißt, die Wächter platzieren sich direkt an der Stelle wo Bakterien eindringen.“
Wichtiger Teil der Signalkette
Im weiteren Verlauf des Projektes will das Team klären, wie genau NOD1 die bakterienbedingten Veränderungen an der Aktinstruktur erkennt, auf welchen Wegen es daraufhin das Alarmsignal für eine Immunreaktion gibt, und welche weiteren Zellbestandteile daran beteiligt sind.
Dazu zählt zum Beispiel das RIP2-Protein, das nach NOD1 das nächste Glied in der Signalkette ist, also die von NOD1 abgegebene Warnung über einen Eindringling weiterleitet.
Auch das dem NOD1-Protein sehr ähnliche NOD2-Protein nehmen die Wissenschaftler unter die Lupe. Beide sind sich zwar ähnlich, NOD1 ist jedoch deutlich besser in der Lage, Veränderungen der Aktinstruktur zu erkennen.
NOD2 spielt außerdem eine Rolle bei der genetischen Veranlagung für die Darmerkrankung Morbus Crohn. „Der Vergleich von NOD1 und NOD2 soll uns zeigen was passiert, wenn die Erkennung von Eindringlingen gestört ist und wie solche Störungen zu Erkrankungen führen können.“
Hintergrund: Forschung mit „unsterblichen“ menschlichen Zellen
Für ihre Experimente verwendet die Gruppe um Prof. Dr. Kufer menschliche Zellen aus dem sogenannen HeLa-Zellstamm. Benannt sind sie nach der Amerikanerin Henrietta Lacks, bei der ein Mediziner die Krebszellen 1951 aus einem Tumor entnahm. Schnell stellte sich heraus, dass die Zellen sich besonders schnell teilten und auch nach einer hohen Zahl Teilungen nicht abstarben.
Labore begannen die Zellen massenhaft zu kultivieren und für die Forschung zur Verfügung zu stellen. Die Zellen wurden seitdem für eine Vielzahl von Experimenten verwendet, unter anderem auch bei der Entwicklung des Impfstoffs gegen Kinderlähmung und in vier Forschungsprojekten, die später einen Nobelpreis erhielten. Schätzungen zufolge wurden insgesamt 50 Tonnen Zellmaterial aus ihnen hergestellt.
Hintergrund zum Projekt „Charakterisierung der Funktion von Aktin-Remodeling in NLR-vermittelten angeborenen Immunreaktionen“
Die DFG fördert das Projekt „Charakterisierung der Funktion von Aktin-Remodeling in NLR-vermittelten angeborenen Immunreaktionen“ mit 430.000 Euro aus dem Programm Sachbeihilfe. Es läuft noch bis Herbst 2018.
Kooperationspartner des Forschungsprojektes sind Prof. Dr. Herbert Schmidt vom Fachgebiet Lebensmittelmikrobiologie und -hygiene der Universität Hohenheim sowie Dr. Angelika Haußer vom Institut für Zellbiologie und Immunologie der Universität Stuttgart.
Hintergrund: Schwergewichte der Forschung
29,5 Millionen Euro an Drittmitteln akquirierten Wissenschaftler der Universität Hohenheim 2016 für Forschung und Lehre. In loser Folge präsentiert die Reihe „Schwergewichte der Forschung“ herausragende Forschungsprojekte mit einem finanziellen Volumen von mindestens 250.000 Euro für apparative Forschung bzw. 125.000 Euro für nicht-apparative Forschung.
Text: Barsch / Klebs
Kontakt für Medien:
Prof. Dr. rer. nat. Thomas Kufer, Universität Hohenheim, Leiter des Fachgebiets Immunologie
T 0711 459 24850, E thomas.kufer@uni-hohenheim.de